Εξαιτίας του μικρού μεγέθους τους, όλα τα εδαφικά κολλοειδή διαθέτουν μια μεγάλη εξωτερική επιφάνεια ανά μονάδα μάζας, ενώ ορισμένα ορυκτά της αργίλου έχουν και μια εσωτερική επιφάνεια μεταξύ των στοιβάδων των φυλλόμορφων κρυσταλλικών μονάδων.
Τα θετικά φορτισμένα ιόντα (κατιόντα) Al+3, Ca+2, Mg+2, K+, H+ και Νa+, έλκονται στις επιφάνειες των αρνητικά φορτισμένων κολλοειδών, ανόργανων όπως η άργιλος (π.χ μοντμοριλλονίτης, βερμικουλίτης) και οργανικών (οργανική ουσία), λόγω δυνάμεων ηλεκτροστατικής έλξης.
Ένα μεμονωμένο κατιόν μπορεί να απομακρυνθεί από το νέφος (σύμπλοκο) και να μετακινηθεί στο εδαφικό διάλυμα. Ταυτόχρονα, ένα άλλο κατιόν ίσου φορτίου με αυτό που απομακρύνθηκε, μετακινείται από το εδαφικό διάλυμα προς το νέφος και παίρνει τη θέση του κατιόντος που απομακρύνθηκε.
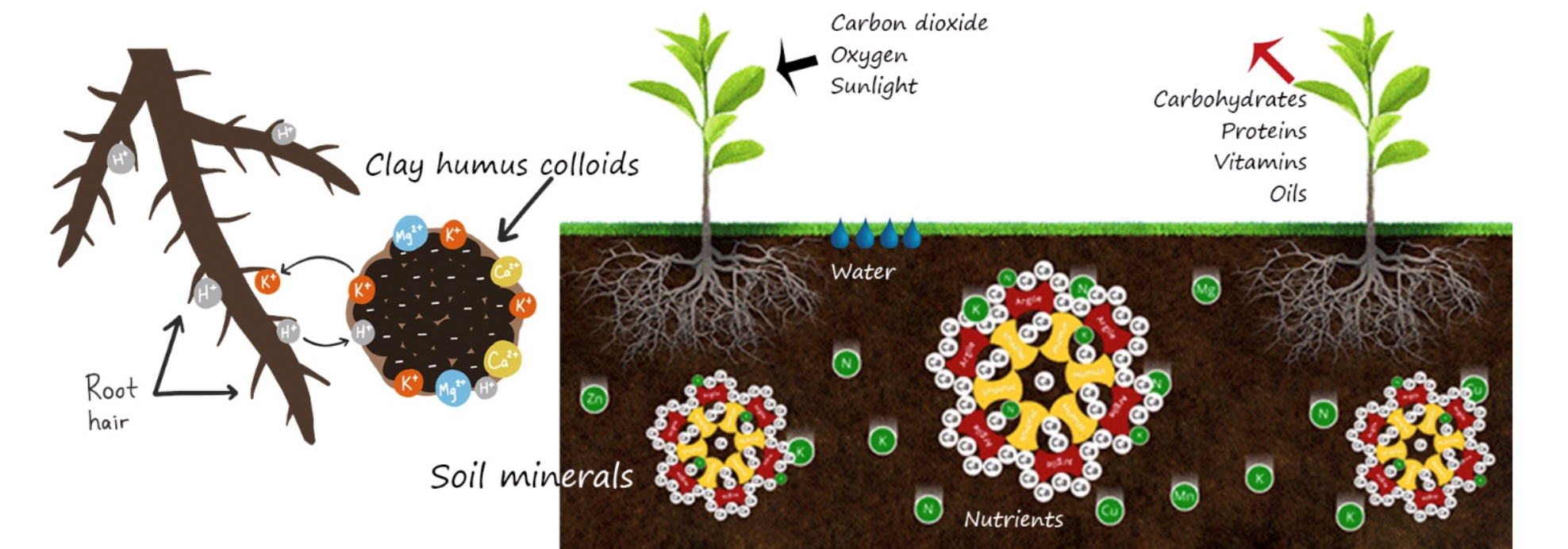
Η διαδικασία αυτή ονομάζεται ανταλλαγή κατιόντων [Σχήμα 1].
Τα κατιόντα που βρίσκονται κοντά στην επιφάνεια των κολλοειδών ονομάζονται προσροφημένα και συγκρατούνται με χαλαρούς δεσμούς σε αυτήν. Τα προσροφημένα κατιόντα επειδή ανταλλάσουν θέσεις με τα κατιόντα που κινούνται ελεύθερα στο εδαφικό διάλυμα (υδατοδιαλυτά), ονομάζονται ανταλλάξιμα κατιόντα.
Ανιόντα όπως Cl-, NO3-, SO42- και PO43-, έλκονται από ορισμένα εδαφικά κολλοειδή με θετικό φορτίο στις επιφάνειές τους, όπως τον γκιμπσίτη [Al(OH)3], τον αιματίτη [Fe2O3] και τον γκαιτίτη [FeOOH].
Η προσρόφηση των ανταλλάξιμων ανιόντων δε συμβαίνει εντατικά όσο στα κατιόντα. Το σύνολο των εδαφικών κολλοειδών, ανόργανων και οργανικών, που συγκρατεί ανταλλάξιμα κατιόντα ή ανιόντα, ονομάζεται σύμπλοκο ανταλλαγής κατιόντων ή ανιόντων. Επιπλέον, τα εδαφικά κολλοειδή έλκουν και συγκρατούν μεγάλο αριθμό μορίων νερού καθώς επηρεάζει η εξωτερική επιφάνεια των κολλοειδών, όσο μεγαλύτερη είναι τόσο περισσότερη ποσότητα νερού συγκρατείται [Πίνακας 1].
Πίνακας 1. Χαρακτηριστικά των ορυκτών της αργίλου και της οργανικής ουσίας (Green, 1986).
|
Είδος ορυκτού |
Χαρακτηριστικά |
||
|
C.E.C. (meq / 100 g) |
Ειδική επιφάνεια |
Εκτατικότητα |
|
|
Οργανική ουσία |
200-400 |
500-800 |
- |
|
Βερμικουλίτης |
100-150 |
600-800 |
Μικρή |
|
Μοντμοριλλονίτης |
80-150 |
600-800 |
Μεγάλη |
|
Ιλλίτης |
10-40 |
65-100 |
Καμία |
|
Χλωρίτης |
10-40 |
25-40 |
Καμία |
|
Καολινίτης |
3-15 |
7-30 |
Καμία |
|
Οξείδια & |
2-6 |
100-800 |
Καμία |
Σχήμα 1. Απεικόνιση της ανταλλαγής κατιόντων.

Φορτίο ορυκτών της αργίλου
Όπως αναφέρθηκε, τα ορυκτά της αργίλου είναι ικανά να συγκρατούν και να ανταλλάσσουν κατιόντα. Η ικανότητά τους οφείλεται στο αρνητικό φορτίο τους που εκδηλώνουν με τους παρακάτω μηχανισμούς:
1) Ισόμορφες αντικαταστάσεις:
Γίνονται στη φάση σχηματισμού του κρυσταλλικού πλέγματος των πυριτικών αργίλων και εκδηλώνονται τόσο στα τετράεδρα πυριτίου όσο και στα οκτάεδρα αργιλίου. Στις αντικαταστάσεις αυτές ορισμένα ιόντα πυριτίου στα τετράεδρα αντικαθίστανται από ισάριθμα ιόντα αργιλίου και για κάθε μία τέτοια αντικατάσταση δημιουργείται περίσσεια ενός αρνητικού φορτίου αφού το τετρασθενές πυρίτιο αντικαθίσταται από το τρισθενές αργίλιο. Οι ισόμορφες αντικαταστάσεις διαφέρουν από ορυκτό σε ορυκτό με αποτέλεσμα να διαφέρει και η τιμή του αρνητικού τους φορτίου. Η τιμή αυτή είναι σταθερή για κάθε ορυκτό και αναφέρεται ως μόνιμο αρνητικό φορτίο.
2) Θραυσιγενείς ακμές:
Τα ορυκτά της αργίλου εκδηλώνουν μία μικρή ποσότητα αρνητικού φορτίου στις ακμές των κρυστάλλων τους, δηλαδή εκεί όπου διακόπτεται η συνέχεια του κρυστάλλου και ελευθερώνονται ιονικοί δεσμοί. Όσο αυξάνεται ο τεμαχισμός του ορυκτού, τόσο μεγαλύτερη θα είναι η ποσότητα του αρνητικού φορτίου. Στις θραυσιγενείς ακμές ή στις επιφάνειες του κρυσταλλικού πλέγματος των ορυκτών της αργίλου, τόσο στα τετράεδρα όσο και στα οκτάεδρα, δημιουργούνται ομάδες Si-OH και Al-OH, οι οποίες με αύξηση pH υφίστανται αποπρωτονίωση με αποτέλεσμα την εκδήλωση αρνητικού φορτίου [Σχήμα 2]. Η τιμή αυτού του αρνητικού φορτίου μεταβάλλεται ανάλογα με το pH γι’ αυτό και χαρακτηρίζεται ως φορτίο εξαρτώμενο από το pH.
Σχήμα 2. Αντίδραση της αποπρωτονίωσης.
|
-SiOH + OH- -SiO- + H2O |
ΙΑΚ και ΙΑΑ
Η ΙΑΚ (Ικανότητα Ανταλλαγής Κατιόντων) εκφράζεται ως ο αριθμός των γραμμομορίων (moles) θετικού φορτίου που είναι προσροφημένος ανά μονάδα μάζας (kg), δηλαδή cmolc / kg. Παλαιότερη μονάδα ήταν τα χιλιοστοϊσοδύναμα (milliequivalents) ανά 100 g, δηλαδή meq / 100 g και ισούται με 1 cmolc / kg. Ένα παράδειγμα, έστω ότι η ΙΑΚ είναι 12, δηλαδή 1 kg εδάφους μπορεί να κρατήσει 12 cmolc ιόντων H+ και μπορεί να ανταλλάξει αυτό τον αριθμό των H+ με τον ίδιο αριθμό φορτίων οποιουδήποτε άλλου κατιόντος [Σχήμα 3, Σχήμα 4, Πίνακας 2].
Τα ασθενώς ενυδατωμένα ιόντα έχουν μεγαλύτερη προσροφητικότητα γιατί οι στοιβάδες νερού παρεμποδίζουν λιγότερο τις ηλεκτροστατικές δυνάμεις. Τα μικρά ιόντα είναι περισσότερο ενυδατωμένα και σύμφωνα με αυτές τις αλληλεπιδράσεις η προσροφητική δράση μειώνεται. Η φθίνουσα σειρά της ισχύος προσρόφησης των ανταλλάξιμων κατιόντων είναι:
Al3+ > Sr2+ > Ca2+ > Mg2+ > Cs+ > K+ , H+ , NH4+ > Na+ > Li+.
Πίνακας 2. Επίδραση του pH στην τιμή της Ι.Α.Κ. του εδάφους και διαφόρων συστατικών του (Σινάνης, 2008).
|
Ι.Α.Κ. σε cmolc / kg |
|||
|
pH |
Οργανική ουσία |
Ορυκτά της αργίλου |
Έδαφος |
|
2,5 |
36 |
38 |
5,8 |
|
3,5 |
73 |
46 |
7,5 |
|
5,0 |
127 |
54 |
9,5 |
|
6,0 |
131 |
56 |
10,8 |
|
7,0 |
163 |
60 |
12,3 |
|
8,0 |
213 |
64 |
14,8 |
Σχήματα 3 και 4. Αναπαραστάσεις της ΙΑΚ.
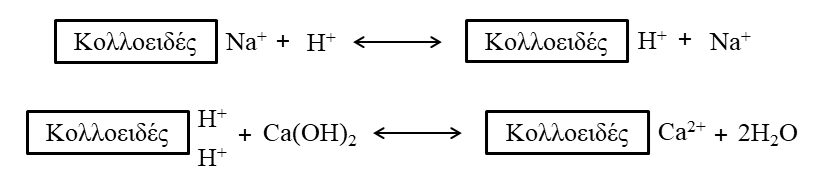
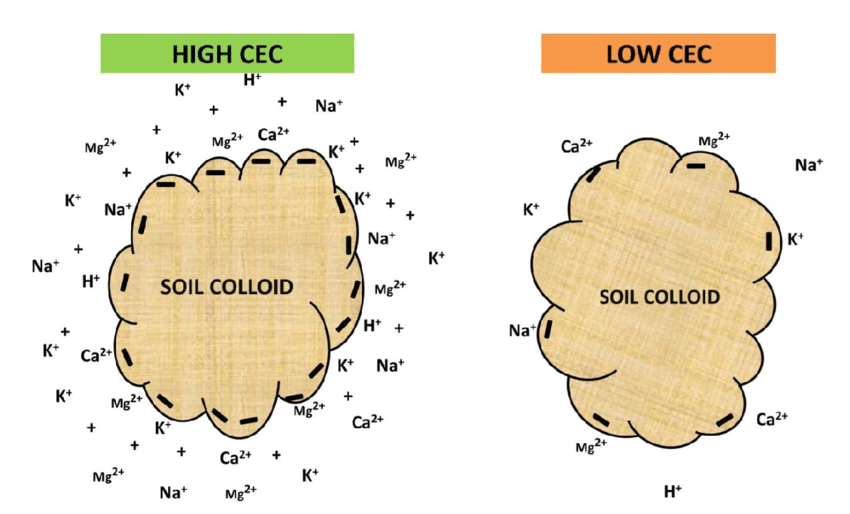
Τα ιόντα Ca+, Al+ και τα H+ είναι αφθονότερα σε υγρές περιοχές ενώ τα Ca2+, Mg2+ και Na+ επικρατούν σε περιοχές με χαμηλή βροχόπτωση.
Σε ένα συγκεκριμένο έδαφος, το ποσοστό των θέσεων ανταλλαγής που καταλαμβάνεται από ένα ορισμένο κατιόν ονομάζεται βαθμός κορεσμού με αυτό το κατιόν. Για παράδειγμα, αν το 40% της ΙΑΚ ικανοποιείται από Ca2+ τότε λέγεται ότι το σύμπλοκο ανταλλαγής έχει βαθμό κορεσμού ασβεστίου 40. Με τον τρόπο αυτό διαπιστώνεται η σχετική αφθονία των πηγών οξύτητας και αλκαλικότητας.
Ο βαθμός κορεσμού με ιόντα Al3+ και H+ δίνει μια ένδειξη των όξινων συνθηκών ενώ ο βαθμός κορεσμού με βάσεις δείχνει μία κατεύθυνση προς την αλκαλικότητα. Τα Ca+2, Mg2+, K+ και Na+ όταν προσροφώνται στα εδαφικά κολλοειδή ανταλλάσσοντας ιόντα H+ και Al3+ αυξάνουν το pH.
Γενικά εμπειρικά συμπεράσματα - Brucket & Rouiller - όταν το pH < ή = 4 ο βαθμός κορεσμού είναι < 10%, όταν το pH = 7 ο βαθμός κορεσμού είναι 60-90%.
Η αυξημένη περιεκτικότητα του εδάφους σε ανταλλάξιμο Na+ είναι παράγοντας παθογένειας, ορίζεται ως βαθμός νατρίωσης (αλκαλίωσης) και εκφράζεται με τον λόγο της % περιεκτικότητας του εδάφους σε εναλλακτικό Na σε σχέση με την ΙΑΚ. Η τιμή της ΙΑΚ εξαρτάται από την περιεκτικότητα σε άργιλο και οργανική ουσία, από την ορυκτολογική σύσταση της αργίλου και από το pH. Η κατανομή των κατιόντων μεταξύ στερεής και υγρής φάσης, στην κατάσταση ισορροπίας, εξαρτάται από τη φύση τόσο του ανταλλάκτη, όσο και των κατιόντων, καθώς επίσης και από τη συγκέντρωσή τους στο εδαφικό διάλυμα και την αναλογία τους σ’ αυτό.
Η αναλογία των κατιόντων στη στερεή φάση είναι διαφορετική απ’ ότι στο εδαφικό διάλυμα με αποτέλεσμα σε ορισμένα κατιόντα να υπάρχει η τάση να προσλαμβάνονται εκλεκτικά από τη στερεή φάση και να συγκρατούντα ισχυρά καθιστώντας δύσκολη την ανταλλαγή τους. Οι ανταλλάκτες εκδηλώνουν εκλεκτικότητα για τα κατιόντα αυτά.
Κατά την ΙΑΑ (Ικανότητα Ανταλλαγής Ανιόντων) τα ανιόντα συγκρατούνται στα εδαφικά κολλοειδή με δύο τρόπους.
Ο πρώτος σχετίζεται με τη συγκράτησή τους με μηχανισμούς προσρόφησης ανιόντων όπως και πριν με τα κατιόντα.
Ο δεύτερος αφορά τις αντιδράσεις τους με τις επιφάνειες οξειδίων και υδροξειδίων και με το σχηματισμό συγκεκριμένων συμπλόκων εσωτερικής στοιβάδας [Σχήμα 5].
Η γενική αρχή της ΙΑΑ είναι ότι τα φορτία των κολλοειδών είναι θετικά και η ανταλλαγή συμβαίνει μεταξύ ανιόντων. Θετικά φορτία παρευρίσκονται στις επιφάνειες του καολινίτη και των οξειδίων σιδήρου και αργιλίου, τα οποία έλκουν ανιόντα όπως SO42-, NO3- και Cl- [Σχήμα 6].
Σχήμα 5. Αναπαράσταση συμπλόκου εσωτερικής στοιβάδας.
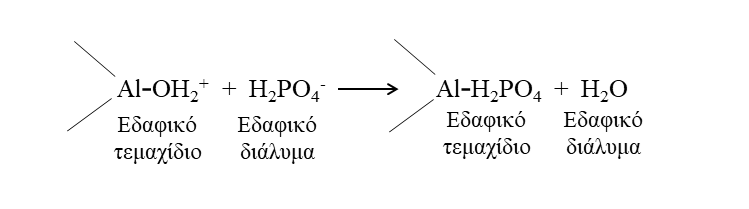
Σχήμα 6. Αναπαράσταση της ΙΑΑ.

Η ανταλλαγή ανιόντων καθιστά διάφορα ανιόντα διαθέσιμα για τα φυτά και επιβραδύνει την έκπλυση τέτοιων ανιόντων από το έδαφος. Σε pH > 6 λόγω αποπρωτονίωσης των ομάδων AL-OH και Fe-OH ή προσρόφησης ιόντων OH-, τα Fe2OH και Al(OH)3 εκδηλώνουν αρνητικό φορτίο. Σε χαμηλά pH ευνοείται η απελευθέρωση ιόντων OH- από ορυκτά με σύσταση Al-OH, ώστε να καθίστανται εναλλακτικά. Το ίδιο συμπεριφέρονται και συστάσεις της μορφής Fe-OH. Οι ρίζες χουμικών συστατικών έλκουν ιόντα H+ παράγοντας θετική φόρτιση στην επιφάνεια του κολλοειδούς τεμαχιδίου. Συνεπώς, η αύξηση του pH ευνοεί την αύξηση της ΙΑΚ και αντίθετα η μείωση του pH οδηγεί σε αύξηση της ΙΑΑ.
Η συγκράτηση των ανιόντων σε εναλλακτική μορφή εξαρτάται όπως και στα κατιόντα, από το ηλεκτρικό σθένος και την ενυδάτωση του ιόντος. Η φθίνουσα σειρά της ισχύος προσρόφησης των ανταλλάξιμων ανιόντων είναι:
PO43- > SO42- > NO3- > Cl-.
Βιβλιογραφία
Bohn, H. L., McNeal, B. L., & O’Connor, G. A., 2001, Soil Chemistry, 3rd ed. John Wiley & Sons, New York.
Brady Nyle C. and Weil Ray. R., 2011, Η φύση και οι ιδιότητες των εδαφών, 14 ed., Εκδόσεις Έμβριο, Αθήνα.
Brady Nyle C. & Weil Ray R., 2016, The nature and properties of soils 15 ed. Columbus: Pearson.
Coleman D. C., Callaham Mac M., Crossley D. A. Jr., 2017, Fundamentals of Soil Ecology 3rd ed., (London: Elsevier Academic Press).
Evangelou V. P. 1998, Environmental Soil and Water Chemistry: Principles and Applications, John Wiley & Sons, New York.
McBride, M.B., 1994, Environmental chemistry of soils. Oxford University Press, New York.
Sposito G. 1989 The chemistry of soils, 2nd ed. Oxford University press. N.Y.
Χουλιαράς Νικόλαoς, 2009, Έδαφος και μέθοδοι μελέτη, Εκδόσεις “ΙΩΝ” Στέλλα Παρίκου & ΣΙΑ Ο.Ε., Αθήνα.
Σινάνης Κωνσταντίνος, 2008, Εδαφολογία, Ηράκλειο.







